
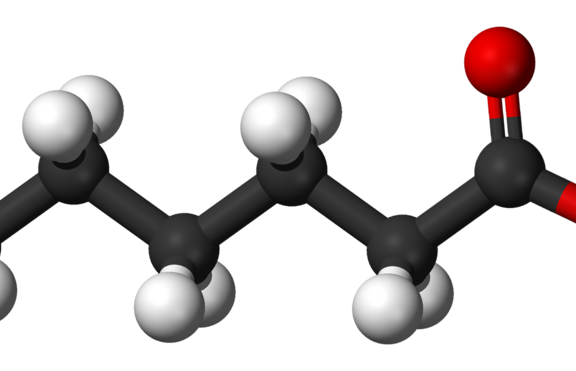
Няполярните въглеводородни вериги на мастните киселини са отговорни за слабата им разтворимост във вода. Лауриновата киселина например (CH3(CH2)10COOH), която се състои от 12 въглеродни атома има разтворимост във вода 0.063 mg/g, тоест много по-ниска от тази на глюкозата например 1,100 mg/g.
Дългите вериги на мастните киселини и малкото двойни връзки понижават разтворимостта им във вода, докато полярната карбоксилна група в тях заедно с къса верига примерно повишават разтворимостта на мастните киселини във вода. При стайна температура (25 градуса Целзий) наситените мастни киселини с дължина на веригата 12-24 C имат консистенция на восък, тоест са по-твърди, докато ненаситените мастни киселини при същите условия са в състояние на мазна течност. Тези различни в точките на топене на мастните киселини зависи от пакетирането, групирането на молекулите им.
При напълно наситените мастни киселини свободно въртене около всеки въглероден атом придава на въглеводородната верига добра гъвкавост. Най-стабилната форма е напълно изпънатата форма, в която страничното пречене на съседните вериги е минимализирано. Тези молекули могат да се групират много плътно една до друга, да образуват кристални структури, където съседните молекули да контактуват помежду си чрез Ван дер Ваалсови взаимодействия.
При ненаситените мастни киселини цис конформацията подпомага образуването на кинк (счупване на веригата). Мастните киселини с една или няколко така наречени кинка не биха могли да се пакетират толкова плътно както напълно наситените мастни киселини и взаимодействията между съседните молекули са по-слаби. Тъй като отнема по-малко топлинна енергия да се разруши тяхната връзка ( на ненаситените мастни киселини) и да се намали подредеността на молекулите, точките им на топене са много по-ниски от тези на наситените мастни киселини със същата дължина.





